द्रव्य का वर्गीकरण (Classification of Matter)
Table of Contents / लेख-सूची
प्रिय मित्रों, आज हम आपके बीच Classification of matter in Hindi को साँझा कर रहे है | Classification of matter in Hindi में पदार्थों के बारे में तथा उनके उदहारण का वर्णन किया गया है | आपको पदार्थों से सम्बन्धित सभी जरुरतमन्द जानकारी इस पोस्ट के मध्यम से मिल जाएँगी |
पदार्थों में हम द्रव्य को आसानी से देख सकते है, सूंघ सकते है तथा आसानी से महसूस भी कर सकते है। आमतौर पर पदार्थों में द्रव्य को भौतिक अवस्था के आधार पर तीन अवस्थाओं में कुछ इस प्रकार विभाजित किया जा सकता है :- ठोस, द्रव एवं गैस में | बोस-आइन्सटीन कण्डनसेट पदार्थ एवं प्लाज्मा की जो अन्य दो भौतिक अवस्थाएँ पाई जाती हैं, परन्तु ये केवल कुछ विशिष्ट परिस्थितियों में ही देख सकते है । बल्कि जब रासायनिक अवस्था के आधार पर पदार्थों में द्रव्य को निम्न प्रकार वर्गीकृत भी किया जा सकता है।
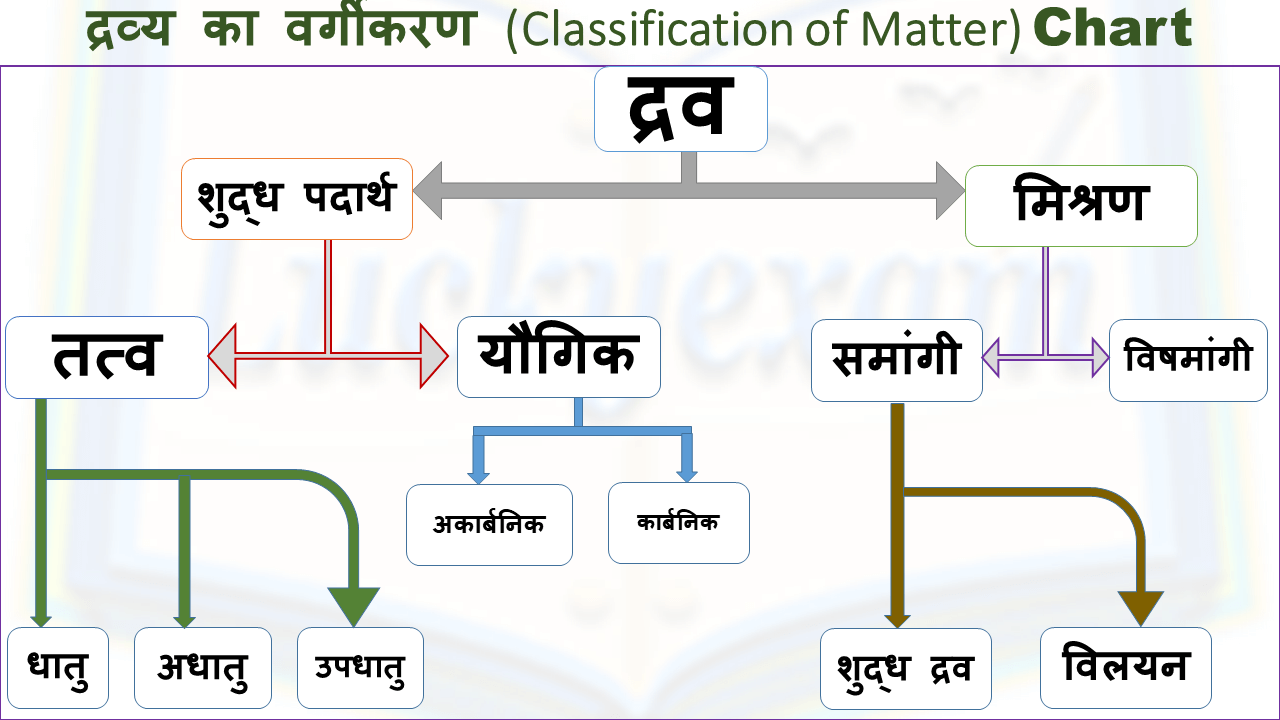
शुद्ध पदार्थ (Pure Substance)
शुद्ध पदार्थ वे पदार्थ होते है जिनका संघटन स्थिर तथा निश्चित होता है वही शुद्ध पदार्थ कहलाते हैं | शुद्ध पदार्थ को पुनः तत्वों तथा यौगिकों दो भागो में बॉटा गया हैं।
A. तत्व (Element)
ये वह शुद्ध पदार्थ है जिसको किसी अन्य अवयवों में अपघटित नहीं किया जा सकता है और इसका निर्माण भी सामान्य रासायनिक या भौतिक विधियों के द्वारा किसी साधारण पदार्थ से नहीं किया जा सकता है वह तत्व कहलाता है।
यह सभी शुद्ध पदार्थ किसी न किसी तत्वों के संयोग से बनते हैं तथा आज तक यह 118 तत्व ज्ञात हैं, जिनमे से 94 पृथ्वी के भीतर पाये जाते हैं :- जैसे कुछ तत्व सोना, चाँदी, लोहा, ऑक्सीजन, हाइड्रोजन, ताँबा, आदि, और जबकि इनमे से शेष बचे तत्व वैज्ञानिकों ने खुद ही प्रयोगशाला में कृत्रिम रूप से बनाये व संश्लेषित किये हैं ।
तत्वों को पुनः तीन भागों में कुछ इस प्रकार विभाजित किया जा सकता है :- धातु, अधातु एव उपधातु
1. धातु (Metal)
उदाहरण :- सोना, चाँदी, लोहा, जिंक आदि।
2. अधातु (Non-metal)
उदाहरण :- ऑक्सीजन, नाइट्रोजन, कार्बन आदि।
3. उपधातु (Metalloid)
उदाहरण :- जर्मेनियम, आस्सेंनिक आदि।
पृथ्वी के पटल पर उपस्थित महत्त्वपूर्ण तत्वों की प्रतिशत मात्रा
क्र.सं. तत्व | मात्रा (%) |
1. ऑक्सीजन (O) | 46.6 |
2. सिलिकॉन (Si) | 27.7 |
3. ऐलुमिनियम (A) | 8.1 |
4. लोहा (Fe) | 5.0 |
5. कैल्सियम (Ca) | 3.6 |
6. सोडियम (Na) | 2.8 |
7. पोटैशियम (K) | 2.6 |
8. मैग्नीशियम (Mg) | 2.1 |
एक सामान्य मनुष्य के शरीर में तत्वों की औसत मात्रा
तत्व | प्रतिशत |
ऑक्सीजन | 65.0 |
हाइड्रोजन | 10.0 |
कैल्सियम | 2.0 |
पोटैशियम | 0.35 |
सोडियम | 0.15 |
मैग्नीशियम | 0.05 |
कार्बन | 18.0 |
नाइट्रोजन | 3.0 |
फॉस्फोरस | 1.0 |
सल्फर | 0.25 |
क्लोरीन | 0.15 |
लोहा | 0.004 |
अन्य तत्व | 0.046 |
B. यौगिक (Compound)
यौगिक पदार्थ होते है जो दो या दो से अधिक तत्वों के मिलकार या रासायनिक संयोग से बनते हैं | यह उनके अवयव तत्वों के परमाणुओं की संख्याओं का अनुपात को नियत रहता है, उन्हें हम यौगिक कहलाते हैं। यौगिक के जो गुण होते है उसके अवयव तत्वों के गुणों से कुछ भिन्न होते हैं।
उदाहरण :- जल (H2O) यह एक यौगिक होते है परन्तु इसमें हाइड्रोजन व ऑक्सीजन के परमाणुओं की संख्या पाई जाती गई, जिसका अनुपात 2 : 1 होता है। यह अनुपात हमेशा स्थिर ही रहता है, चाहे जल को किसी भी स्रोत से प्राप्त किया जाए | अन्य उदहारण :- ऐल्कोहॉल, शर्करा, अमोनिया, कार्बन डाइ-ऑक्साइड, नमक, क्लोरोफॉर्म आदि |
मिश्रण (Mixture)
द्रव्य जो दो या दो से अधिक द्रव्यों मिला देने पर बनते हैं चाहे उनका अनुपात क्कुह भी हो, वह मिश्रण कहलाते हैं। मिश्रण के गुण :- यह उसके अवयवों के गुणों का मिश्रण होते हैं।
उदाहरण :- चीनी एवं नमक का एक मिश्रण, नमक एवं पानी का एक मिश्रण, लड़की के बुरादे एवं लाह के कणो का एक मिश्रण। वायु, नदी का जल, मिश्र-घातु, काच, दूध, आदि मिश्रण के अन्य उदाहरण है | मिश्रण के जो गुण होते है वह सदैव आवयवों के स्वाभाविक गुणों को प्रदर्शित करता है।
मिश्रण के भी दो प्रकार होते हैं।
1. समांगी मिश्रण (Homogeneous Mixture)
2. विषमांगी मिश्रण (Heterogeneous Mixture)
समांगी मिश्रण (Homogeneous Mixture)
समांगी मिश्रण में किसी भी भाग का संगटन, उसके दूसरे किसी भी भाग के संगटन के बिलकुल समान होता है; उदहारण के लिए चीनी या नमक का जलीय विलयन। समांगी मिश्रण :- यह मिश्रण एक ही प्रावस्था रहता है।
विषमांगी मिश्रण (Heterogeneous Mixture)
विषमांगी मिश्रण में सभी विभिन्न भागों का संगठ, एक-दूसरे से बिलकुल भिन्न होता है; जैसे उदहारण के लिए बालू एवं लोहे की छीलन का एक मिश्रण, कंक्रीट (सीमेन्ट, बालू व जल का मिश्रण )। विषमांगी मिश्रण :- यह मिश्रण अलग-अलग प्रावस्थाओं में रहता है।
मिश्रण का पृथक्करण (Separation of Mixture)
मिश्रण में मौजूद विभिन्न अवयवों को विभिन्न विधियों के द्वारा पृथक् किया जा सकता है। इस मिश्रण को पृथक् करने हेतु निम्न विधियों उपयोग किया जाता है |
अपकेन्द्रण (Centrifugation)
अपकेन्द्रण विधि इस सिद्धान्त पर आधारित है जो कि कुछ तेजी से घुमाने पर सभी सघन कण एक साथ नीचे बैठ जाते हैं और सभी हल्के कण सतह पर आ जाते हैं तथा इसका प्रयोग का एक उदहारण है मक्खन से क्रीम निकालना |
क्रिस्टलन (Crystallisation)
क्रिस्टलन विधि सभी ठोस वस्तुओं के शुद्धिकरण तथा पृथक्करण के लिए उपयोग किया जाता है | क्रिस्टलन विधि में सभी अशुद्ध ठोस पदार्थ या सभी मिश्रण पदार्थ को उचित विलायक के साथ पूरी तरह मिलाकर गर्म करते हैं उदहारण जल, ऐल्कोहॉल, ऐसीटोन आदि | इस विधि के बाद विलयन को उसी गर्म अवस्था में ही पूरी तरह छान लेते हैं, उसमे से प्राप्त छनित्र विलयन को ठण्डा करने के बाद शुद्ध पदार्थ के क्रिस्टल को प्राप्त किया जाता है। इस विधि के दौरान वह सभीअशुद्धियाँ मातृ-द्रव में ही घुली रहती है। क्रिस्टलों को पूरी तरह अलग करके जल शोषित्र के द्वारा पूर्ण रूप से सुखा लिया जाता है।
ऊर्ध्वपातन (Sublimation)
ऊर्ध्वपातन की विधि यह कहती है कि यदि किसी ठोस पदार्थ का गर्म करने के बाद सीधे वाष्प में बदलता है और फिर उसे ठण्डा किए जाने के बाद वह पुन: सीधे ठोस अवस्था में आ जाता है तो उस ऊर्ध्वपातन कहते है|
ठोस पदार्थ गर्म करने पर ↔ ठंडा करने पर वाष्प
ऊर्ध्वपातन विधि का उपयोग अनुर्ध्वपाती एवं ऊर्ध्वपाती के पदार्थों को अलग करने में किया जाता हैं।
इस प्रकार से किसी भी मिश्रण को गर्म करने के बाद ऊर्ध्वपाती ठोस सीधे वाष्प अवस्था में परिवर्तित होता है। इसी वाष्प को अलग करने के बाद ठण्डा करते हैं ऐसे ही इस तरह दोनों ठोस पृथक् किये जाते हैं। कुछ ऊर्ध्वपाती पदार्थ उदहारण के लिए उपस्थित है :- बेन्जोइक अम्ल, नैफ्थेलीन, नौसादर, कपूर, ऐन्थ्रासीन आदि |
आसवन (Distillation)
आसवन विधि में किसी द्रव को गर्म करने के बाद वाष्पों में बदलना तथा इसी वाष्पों को ठण्डा होने देना तथा फिर से द्रव में परिवर्तित करना आसवन कहलाता हैं।
आसवन = वाष्पीकरण + संघनन
उपयोग (Uses)
आसवन के कुछ प्रमुख उपयोग निम्नलिखित है,
* वाष्पशील पदार्थों को अवाष्पशील पदार्थों से विभाजित करना |
* कार्बनिक द्रवों के मिश्रण का विभाजन
* साधारण जल से आसुत जल बनाने की विधि
आसवन को कुछ विधियों में विभाजित किया जाता है।
प्रभाजी आसवन (Fractional Distillation)
प्रभाजी आसवन विधि के द्वारा उन सभी मिश्रित द्रवों को अलग करते हैं, जिनके क्वथनांकों का अन्तर बहुत ही कम होता है और न तो यह एक स्थिर क्वथनांकी मिश्रण बनाते हों, न ही यह क्वथनांक से बिलकुल पूर्व अपघटित होते हों। प्रभाजी आसवन विधि में सभी विभिन्न प्रकार के प्रभाजक स्तम्भों का प्रयोग बिलकुल किया जाता है। उदहारण के लिए पेट्रोलियम में से शुद्ध पेट्रोल, डीजल, मिट्टी का तेल, आदि को प्रभाजी आसवन के द्वारा अलग किया जाता है। इस विधि द्वारा द्रवित वायु से विभिन्न गैसे भी अलग की जाती हैं।
भाप आसवन (Steam Distillation)
इस विधि में जल में अमिश्रणीय एवं भाप में उपस्थित वाष्पशील कार्बनिक यौगिकों का शोधन भाप आसवन विधि के द्वारा किया जाता है। वे कार्बनिक यौगिक जिनका वाष्पदाब बहुत अधिक होता है तथा जो अपने क्वथनांक पर आसानी से अपघटित हो जाते हैं वह इस विधि के द्वारा ही शोधित किये जाते है |
उदाहरण :- नाइट्रोफीनॉल तथा p-नाइट्रोफीनॉल के मिश्रण का विभाजन करना, ऐनिलीन, तारपीन के तेल आदि का शोधन करना ।
द्रव्य की कठोरता
द्रव्य की कठोरता :- उसमें खरोच (Scratch) की प्रतिरोधक क्षमता पर यह निर्भर करती है। इसका मापन मोह के कठोरता मापांक (Moh’s Hardness Scale) द्वारा करते है।
द्रव | कठोरता |
हीरा | 10 |
कोरण्डम | 9 |
टोपाज | 8 |
क्वाट्ट्ज | 7 |
सीसा | 6.5 |
फेल्सपार | 6 |
For latest updates you can check below link:-
Facebook page
www.facebook.com/Luckyexam
YouTube channel:-
www.youtube.com/Luckyexam
Telegram:-
t.me/Luckyexam
